Saikne starp magnija deficītu un novecošanos: jaunas atziņas no šūnu pētījumiem

Magnes Res. Autora manuskripts; pieejams PMC arhīvā (2009. gada 8. decembrī)
Publicēts gala rediģētajā formā kā:
Magnes Res. 2008 Jun; 21(2): 77–82.
Saikne starp magnija deficītu un novecošanos: jaunas atziņas no šūnu pētījumiem
David W. Killilea1 un Jeanette A.M. Maier2
Kopsavilkums
Vairums cilvēka šūnu var dalīties tikai ierobežotu reižu skaitu, pirms tās zaudē spēju dalīties, šo fenomenu sauc par senescenci (novecošanu), kam organisma līmenī ir nozīme novecošanas procesa regulācijā. Jaunākie pētījumi liecina, ka šūnu kultūra ar zemu magnija (Mg) daudzumu paātrina cilvēka endotēlija šūnu un fibroblastu senescenci. Ņemot vērā vairākas kritiski svarīgas Mg funkcijas, Mg nepietiekamība šķietami traucētu šūnu metabolismu, kas varētu ietekmēt senescences procesu. Tā kā i) ir vairāki pierādījumi, kas saista zemu Mg līmeni ar novecošanu un ar vecumu saistītām slimībām, un ii) Rietumu diētas saturs ir ar samērā zemu Mg daudzumu, mēs ierosinām, ka, plaši koriģējot ar uzturu uzņemto Mg daudzumu, varētu tikt veicināts veselīgāks novecošanas process un nodrošināta ar vecumu saistītu slimību profilakse.
Atslēgvārdi: magnijs, novecošana, senescence, endotēlijs, fibroblasti
Novecošana tiek raksturota kā pakāpeniska fizioloģisko funkciju pasliktināšanās. Ir ierosināts, ka šo sarežģīto procesu ietekmē gan ģenētiskie, gan vides (uzturs, dzīvesveids) faktori ar aptuveno attiecību 30:70 [1], neskaitot stohastisko (gadījuma) varbūtību. Vairāki pierādījumi saista zemu magnija (Mg) līmeni ar novecošanu un ar vecumu saistītām slimībām. Savukārt ir jāatzīmē, ka novecošana pati par sevi ir Mg deficīta riska faktors [2, 3], tādējādi veidojot apburto loku, kas veicina novecošanai raksturīgo klīnisko īpašību attīstību. Interesanti, ka ilgstoša, mērena Mg deficīta diēta palielina kardiovaskulāro risku žurku modelī, kas saistīts ar novecošanās procesu, ievērojami paaugstinot asinsspiedienu un iekaisuma marķierus [4]. Turklāt zems Mg līmenis pētījumos ar cilvēkiem korelē ar atmiņas pasliktināšanos, kas saistīta ar novecošanu [5], neirodeģeneratīvām slimībām [6], samazinātu muskulatūras aktivitāti [7], insulīna rezistenci [8], osteoporozi [9] un dažu audzēju attīstību [10]. Visi šie dati uzsver Mg deficīta ietekmi uz novecošanas procesu in vivo. Šūnu mehānismi, kas veicina novecošanas fenotipu, nav pilnībā izskaidroti, taču aizvien vairāk pierādījumu liecina, ka šajos procesos ir iesaistītas senescentas šūnas. Ņemot vērā vairākas kritiski svarīgas Mg funkcijas, Mg nepietiekamība šķietami traucētu šūnu metabolismu, kas varētu ietekmēt senescences procesu.
Iesaistītie šūnu un molekulu mehānismi tikai nesen ir kļuvuši skaidrāki, jo ir pierādīts, ka šūnu kultūra ar zemu magnija (Mg) daudzumu veicina cilvēka endotēlija šūnu un fibroblastu senescenci [11, 12].
Šūnu senescence
Normālas cilvēka diploīdu šūnu kultūras dalās tikai ierobežotu reižu skaitu pirms šūnu senescences, gluži kā novecošanās procesa gaita organisma līmenī. Šūnu dalīšanās spējām sasniedzot to robežu, notiek izmaiņas simtiem mainīgajos parametros no molekulārā līdz veselas šūnas līmenim, un tās ir analoģiskas izmaiņām, ko novēro novecojot cilvēkiem un dzīvniekiem [13]. Senescences novecošanās teorija ierosina, ka pakāpeniska senescentu šūnu uzkrāšanās nobriedušos organismos veicina novecošanās fenotipu, izsmeļot audu atjaunošanās spēju un traucējot to homeostāzi [14]. Senescentas šūnas tik tiešām pārtrauc vairoties un tajās norit izteiktas izmaiņas gēnu ekspresijas līmenī, iespējams, hromatīna struktūras reorganizācijas dēļ [15]. Dalīšanās senescenci cilvēka šūnās vienmēr var inducēt atkārtota šūnu pavairošana in vitro, kas izraisa telomēru saīsināšanos. Citkārt priekšlaicīgu senescenci var inducēt dažādi paaugstināta stresa apstākļi, piemēram, DNS bojājums un oksidatīvais stress [15]. Pastāv vairāki molekulāri mehānismi, kas noved pie senescences un tie norāda saistību ar audzēju supresoriem p53 un pRb. Viens no p53 darbības mērķa proteīniem ir ciklīnatkarīgās kināzes (Cdk)-E inhibitors – p21, kā pastiprinātu ekspresiju nodrošina aktivēts p53, noritot DNS bojājumam un/vai saīsinoties telomērām [16]. Ir pierādīts, ka p21 ir liela nozīme senescences regulācijā, jo tas ir stipri paaugstināts vecāku cilvēku fibroblastos un endotēlija šūnās [17]. Taču pRb mehānisms šķietami saistīts ar specifiskām situācijām, kad tiek inducēts Cdk4-Cdk6 inhibitors p16, tādējādi nodrošinot priekšlaicīgu senescenci [15]. Izplatītāks kļūst uzskats, ka p53/p21 mehānisms galvenokārt veicina oksidatīvā stresa un/vai telomēru saīsināšanās izraisītu senescenci, turpretim p16-pRb mehānisms veicina citu stresa faktoru izraisītu senescenci.
Mg saistība ar senescenci
Mg, otrs izplatītākais intracelulārais katjons pēc kālija, spēlē svarīgu lomu šūnu funkciju nodrošināšanā. Vairāki in vitro pētījumi patiešām ir pierādījuši Mg mijiedarbību ar fosfolipīdiem, proteīniem un nukleīnskābēm [18]. It īpaši tas attiecināms uz Mg spēju ietekmēt vairāku enzīmu katalītisko aktivitāti un to labi raksturo Mg spēja nodrošināt fosforilācijas reakcijas, veidojot ATP-Mg kompleksus, kas piesaista substrātu pie enzīmu aktīvajiem centriem [18]. Turklāt Mg stabilizē DNS struktūru, veicina DNS replikāciju un transkripciju, ietekmē RNS translāciju, inducē ribosomu darbību un regulē jonu kanālu atvēršanu un aizvēršanu [18]. Mg deficīts izraisa oksidatīvo stresu dažāda veidu šūnās, ieskaitot cilvēka šūnās [19], kas, iespējams, sekmē šūnu senescenci, veicinot telomēru saīsināšanos. Paaugstinātu oksidatīvo stresu daļēji vari izraisīt izmaiņas mitohondriju funkcijās, jo normālai mitohondriju funkcionētspējai ir nepieciešams atbilstošs Mg daudzums [20]; mitohondriju disfunkcija ir bieži novērota parādība novecošanas laikā. Tādējādi zems Mg līmenis var paātrināt šūnu senescenci, apdraudot DNS stabilitāti, proteīnu sintēzi un šūnu enerģijas metabolismu.
Pierādījumi liecina par to, ka “Rietumu diētas” sastāvā ir samērā zems Mg daudzums, jo priekšroka tiek dota ēdieniem ar daudz kalorijām un zemu mikrouzturvielu daudzumu, ūdenī un augsnē ir zems Mg līmenis, kā arī daudzu pārtikas produktu pārstrādes dēļ, kamēr “Austrumu diēta”, kam raksturīgs lielāks augļu un dārzeņu īpatsvars, ir bagāta ar Mg [21, 22]. Šī atšķirīgā katjonu uzņemšanas pieeja ar uzturu var palīdzēt izskaidrot retāku sirds un asinsvadu slimību sastopamību Austrumu valstīs, salīdzinot ar Rietumu populāciju. Turklāt ir jāatceras, ka Mg deficīts ir nozīmīga klīniskā komplikācija, kas rodas pacientiem ar cukura diabētu, nieru mazspēju, pacientiem, kuri tiek ārstēti ar noteiktām diurētisko vai pretvēža līdzekļu grupām, kā arī alkoholiķiem.
Mg deficīts un endotēlija senescence
Kā vairumam normālu eikariotisku šūnu, endotēlija šūnām ir ierobežotas spējas dalīties un funkcionēt, neatkarīgi no tā, vai tās tiek kultivētas in vitro vai transplantētas kā lēveri in vivo. Mēs esam pierādījuši, ka īslaicīga [11] un ilgstoši (nepublicēti rezultāti) zema Mg vide veicina dažādu īpašību iegūšanu, kas parasti ir saistītas ar endotēlija senescenci. Mg deficīta apstākļos cilvēka endotēlija šūnas palielinājās, kļuva garākas, vakuolizētas un uzrādīja ar senescenci saistītu β-galaktozidāzes aktivitāti. Tās arī paaugstināja p21 ekspresiju, kas izraisīja priekšlaicīgu, ar šūnu disfunkciju saistītu senescenci [23]. Zemos Mg apstākļos endotēlija šūnas arī pārekspresēja interleikīnu 1α (IL-1α), kas tiek uzskatīts par endotēlija senescences marķieri, jo IL-1α ekspresijas apturēšana paaugstina endotēlija šūnu dzīvildzi [24–26]. Papildus tam, zems Mg līmenis paaugstināja plazminogēna aktivatora inhibitora-1 (PAI-1) ekspresiju [24]. PAI-1 netiek uzskatīts tikai par senescences marķieri, jo tas ir gan nepieciešams, gan pietiekams, lai inducētu dalīšanās senescenci, kas samazina p53 ekspresiju [27]. Joprojām nav skaidrs mehānisms, kā zems Mg līmenis veicina endotēlija senescenci. Nesen pierādīts, ka Mg deficīts izraisa pārejošu oksidatīvo stresu, kas noved pie oksidatīva rakstura DNS bojājumiem endotēlija šūnās [28]. Tāpēc ir pamatoti ierosināt, ka Mg deficīts izraisa stresa inducētu priekšlaicīgu senescenci. Saistībā ar minēto jāatzīmē, ka mēs esam novērojuši, ka endotēlija šūnas zemā Mg vidē pārekspresē hsp70 (nepublicēti rezultāti), šie rezultāti atbilst pierādījumiem par paaugstinātu hsp70 līmeni senescentās šūnās normālos apstākļos un nestimulētā vidē [29]. Interesanti, ka ir ziņots arī par to, ka cilvēka endotēlija oksidatīvais stress palielinās līdz ar novecošanos [30]. Iespējams arī, ka zems Mg līmenis var saīsināt telomēras, destabilizēt hromatīnu un izraisīt “senescences gēnu” ekspresiju.
Mg deficīts un fibroblastu senescence
Primāri diploīdi fibroblasti ir bieži lietots šūnu kultūras modelis šūnu senescences pētījumos. Vairākos īstermiņa pētījumos jau iepriekš ir pierādīts, ka zems Mg līmenis ietekmē fibroblastu augšanu [31–33]. Autori Killilea un Ames nesen pierādīja, ka ilgstoša cilvēka fibroblastu kultivēšana mēreni zemos Mg apstākļos izraisīja paātrinātu šūnu senescenci [12]. Līdzīgi kā pētījumos ar endotēlija šūnām, zemos Mg apstākļos kultivēti fibroblasti uzrādīja no devas atkarīgu šūnu izmēra palielināšanos un ar senescenci saistītu β-galaktozidāzes aktivitāti. Šūnu kultūras, kas augušas nepietiekamos Mg apstākļos arī uzrādīja palielinātu p16 un p21 ekspresiju, kas varētu izskaidrot dalīšanās spēju zudumu šajā šūnu populācijā. Vienlaikus zema Mg daudzuma kultūrās telomēru garumi bija īsāki, salīdzinot ar standarta Mg daudzuma kultūrām vienā laika periodā. Izteiktāka telomēru saīsināšanās varētu būt veicinājusi arī paātrinātu dalīšanās senescenci fibroblastos, kas kultivēti zema Mg daudzuma apstākļos, lai gan mijiedarbība starp telomēru zudumu un senescenci ir sarežģīta. Telomēru disfunkciju fibroblastos, kas rodas zema Mg daudzuma apstākļos, var izraisīt citi to veicinošie faktori, piemēram, oksidatīvais stress. Wright et al., izmantojot to pašu fibroblastu šūnu līniju, kādu izmantoja Killilea un Ames, ziņoja, ka populāciju senescenci šķietami vairāk regulē oksidatīvais stress, nevis telomēru disfunkcija [34]. Viens no iespējamiem paaugstināta oksidatīvā stresa cēloņiem šūnās ir traucēta mitohondriju homeostāze, kas ir izplatīta novecojošās šūnās un ir dokumentēta citos mikrouzturvielu deficītu modeļos [20, 35]. Iespējams tas nav pārsteidzoši, ka Killilea un Ames novēroja mitohondriju disfunkcijas pazīmes arī zema Mg daudzuma fibroblastu kultūrās, salīdzinot ar standarta Mg apstākļiem (nepublicēti rezultāti). Citi ziņojumi liecina, ka Mg deficīts ietekmē mitohondriju metabolismu un bioenerģētiku [36]. Tomēr sākotnējās metaboliskās reakcijas, ko izraisa zems Mg līmenis, kas noved pie paātrinātas šūnu novecošanos, joprojām tiek precizētas.
Mg deficīta sekas un šūnu senescence – ar vecumu saistītas slimības
Pretēji sākotnējiem iespaidiem, šūnu senescence nav pilnībā nevēlams process; pašreizējā izpratne liecina, ka šis process ir aizsargreakcija, kas izraisa augšanas apturēšanu šūnās, kuras uzkrājušas bojājumus vai mutācijas kaitīgā līmenī [37]. Tomēr monētas otra puse ir tā, ka senescentas šūnas, it īpaši senescenti stromas fibroblasti, epitēlija un endotēlija šūnas, sekretē faktorus, kas var izjaukt audu uzbūvi. Domājams, ka viens no galvenajiem etioloģiskajiem faktoriem, kas izraisa ar vecumu saistītas slimības, ir senescentu šūnu uzkrāšanās audos. Interesanti atzīmēt, ka endotēlija šūnas, kas saistītas ar senescences fenotipu, ir atrodamas cilvēka aterosklerotiskajos bojājumos un ir pierādīts, ka endotēlija senescence veicina ateroģenēzi [38]. Senescenti fibroblasti tiek saistīti arī ar vecumu saistītām slimībām, ieskaitot palēninātu brūču dzīšanas spēju dažos [39], taču ne visos modeļos [40]. Vairums pierādījumu saista zemu Mg līmeni ar šūnu senescenci un ar vecumu saistītām slimībām.
Mg deficīta un šūnu senescences sekas – vēzis
Šūnu senescence ir spēcīgs audzēju supresora mehānisms, kas neatgriezeniski aptur vairošanos, lai mazinātu neoplastiskas pārmaiņas. Ir uzrādīts, ka senescentas šūnas var modificēt audu vidi, lai, mijiedarbojoties ar onkogēnām mutācijām, veicinātu ar vecumu saistītu audzēju attīstību [37, 41]. Ir iespējams, ka Mg deficīts var paātrināt senescences fenotipu in vivo, kas varētu veicināt audzēju attīstību. Mg ir sarežģīta loma vairākos vēža bioloģiskajos aspektos, sākot no neoplastiskas transformācijas līdz audzēja augšanai un progresijai [10]. Jāatzīmē, ka eksperimentālā peļu (Murine) modelī ilgstoša, nepietiekama Mg daudzuma diēta kavēja primārā audzēja augšanu tiešā veidā (kavējot audzēja šūnu vairošanos) un netiešā veidā (kavējot angioģenēzi un veicinot iekaisuma atbildes reakciju), turpretī modelis šķietami dod priekšroku metastāzēm [42–43]. Ir vilinoši spekulēt, ka zemā Mg daudzuma angiostatiskā iedarbība in vivo varētu būt saistīta ar senescencei līdzīga fenotipa izveidošanu endotēlija šūnās, savukārt palielināto metastāžu daudzumu varētu saistīt ar stromas remodelāciju, ko veic senescentās šūnas, izdalot molekulas, kas rada invazīva rakstura mikrovidi. Vairāku šūnu kultūru pētījumu pamatā ir novērojums, ka transformētām šūnām ir spēja vairoties zemākā Mg daudzuma vidē, nekā primārām, neizmainītām šūnām [12, 31–33]. Tādējādi mēreni izteiktā Mg deficīta vidē (iespējamais scenārijs cilvēku populācijā, kas ievēro Retumu diētu), audzēja šūnai var veidoties augšanai izdevīgi apstākļi, ja saglabājas pietiekams Mg daudzums, lai varētu turpināt audzēja šūnu procesus. Tomēr joprojām saglabājas jautājumi par Mg deficīta lomu audzēja gadījumā: sabiedrotais vai ienaidnieks?
Noslēguma secinājumi
Nepieciešami papildu pētījumi, lai atklātu detaļas, kas saista zemu Mg līmeni ar šūnu senescenci, taču 1. attēlāir apkopoti pašlaik zināmie darbības ceļi, kā Mg deficīts var ietekmēt šūnu senescenci. Šūnu novecošanas nozīme organisma līmenī joprojām ir pretrunīgs jautājums, bet šim procesam ir pieaugošs atbalsts. Zema Mg daudzuma ietekme, kas veicina šūnu senescenci, var būt klīniski nozīmīga, ja pastāv cēloņsakarība.
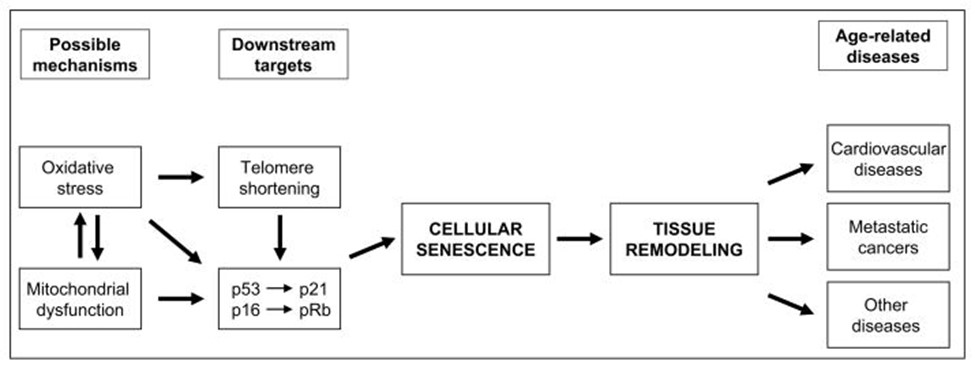
Magnija deficīta stāvokļa laikā aktivēto šūnu mehānismu ceļi, kas var veicināt ar vecumu saistītu slimību attīstību.
Novecošana ir ne tikai svarīgs bioloģisks aspekts, bet arī svarīgs sociālekonomisks, ģeopolitisks un emocionāls jautājums, kas ietekmē industrializētās valstis, kurās strauji pieaug gados vecāku pilsoņu skaits. Balstoties uz epidemioloģiskiem, šūnu un molekulārajiem pierādījumiem, mēs ierosinām, ka, plaši koriģējot ar uzturu uzņemto Mg daudzumu, varētu tikt veicināts veselīgāks novecošanas process un nodrošināta ar vecumu saistītu slimību profilakse.